what is molecular orbital theory.आण्विक कक्षीय सिद्धांत (MOT) का व्यापक परिचय और उदाहरण। जानें कैसे अणुओं में कक्षीयों का संयोजन बंधन की स्थिरता, प्रकार, और संरचना को प्रभावित करता है। सरल आरेखों के साथ विभिन्न अणुओं के 10 उदाहरण।
what is molecular orbital theory
आण्विक कक्षीय सिद्धांत (MOT) रसायन विज्ञान में एक सिद्धांत है जो अणुओं में इलेक्ट्रॉनों के व्यवहार और उनके बंधन बनाने के तरीके को समझाने के लिए विकसित किया गया है। इस सिद्धांत के मुख्य बिंदु निम्नलिखित हैं:
- आण्विक कक्षीय की परिभाषा:
- आण्विक कक्षीय एक ऐसी गणितीय फ़ंक्शन है जो किसी अणु में इलेक्ट्रॉनों की स्थिति को दर्शाता है। यह कक्षीय एकल परमाणु कक्षीयों के संयोजन से बनता है।
- सुपरपोजीशन और संयोजन:
- जब दो परमाणु मिलते हैं, तो उनके परमाणु कक्षीय आपस में सुपरपोज होकर नई कक्षीयें बनाते हैं जिन्हें आण्विक कक्षीय कहा जाता है।
- संयोजन के दो तरीके होते हैं: जोड़ (bonding molecular orbital) और घटाव (anti-bonding molecular orbital)। जोड़ से स्थिर कक्षीयें बनती हैं जो इलेक्ट्रॉनों को आकर्षित करती हैं, जबकि घटाव से अस्थिर कक्षीयें बनती हैं।
- बॉन्डिंग और एंटी-बॉन्डिंग कक्षीयें:
- बॉन्डिंग कक्षीयें तब बनती हैं जब दो परमाणु कक्षीयें एक ही फेज में होती हैं, जिससे एक स्थिर कक्षीय बनता है। यह कक्षीय इलेक्ट्रॉनों को दो परमाणुओं के बीच बांधने में मदद करता है।
- एंटी-बॉन्डिंग कक्षीयें तब बनती हैं जब दो परमाणु कक्षीयें विपरीत फेज में होती हैं, जिससे एक अस्थिर कक्षीय बनता है। यह कक्षीय बंधन को कमजोर करता है।
- इलेक्ट्रॉनिक संरचना:
- एक अणु में इलेक्ट्रॉनों की स्थिति को दर्शाने के लिए इलेक्ट्रॉनिक संरचना का उपयोग किया जाता है। इलेक्ट्रॉन सबसे पहले बॉन्डिंग कक्षीय में प्रवेश करते हैं और फिर अगर आवश्यक हो तो एंटी-बॉन्डिंग कक्षीय में।
- हाइब्रिडाइजेशन:
- विभिन्न परमाणु कक्षीय आपस में मिलकर हाइब्रिड कक्षीय बनाते हैं जो कि आण्विक कक्षीय सिद्धांत के अंतर्गत आता है। यह हाइब्रिडाइजेशन बंधन के कोण और बंधन की लंबाई को निर्धारित करता है।
- बॉन्ड ऑर्डर:
- बॉन्ड ऑर्डर का निर्धारण बॉन्डिंग और एंटी-बॉन्डिंग कक्षीयों में इलेक्ट्रॉनों की संख्या से किया जाता है। इसे निम्नलिखित तरीके से गणना किया जाता है:
- उच्च बॉन्ड ऑर्डर का अर्थ है कि अणु अधिक स्थिर है।
- बॉन्ड ऑर्डर का निर्धारण बॉन्डिंग और एंटी-बॉन्डिंग कक्षीयों में इलेक्ट्रॉनों की संख्या से किया जाता है। इसे निम्नलिखित तरीके से गणना किया जाता है:
- आण्विक स्पेक्ट्रा:
- आण्विक कक्षीय सिद्धांत का उपयोग आण्विक स्पेक्ट्रा को समझने के लिए भी किया जाता है। यह अणु के ऊर्जास्तर और उनके ट्रांज़िशन्स को समझने में मदद करता है।
आण्विक कक्षीय सिद्धांत से हम अणुओं के बीच बनने वाले बंधनों की मजबूती, प्रकार और अणु की स्थिरता के बारे में विस्तृत जानकारी प्राप्त कर सकते हैं। यह सिद्धांत रासायनिक प्रतिक्रियाओं और अणुओं की भौतिक व रासायनिक गुणधर्मों की भविष्यवाणी करने में महत्वपूर्ण भूमिका निभाता है।
आण्विक कक्षीय सिद्धांत (MOT) के 10 उदाहरण निम्नलिखित हैं:
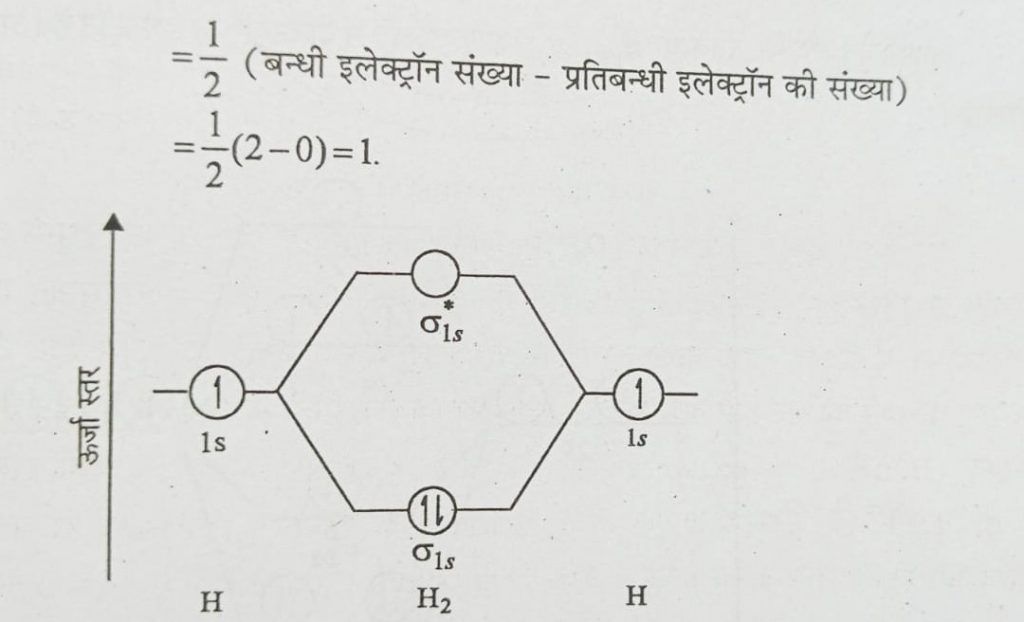
- हाइड्रोजन अणु (H₂):
- दो हाइड्रोजन परमाणु मिलकर एक बॉन्डिंग कक्षीय (σ1s) बनाते हैं। इसमें दो इलेक्ट्रॉन होते हैं, जिससे बॉन्ड ऑर्डर 1 होता है और यह अणु स्थिर होता है।
- हीलियम अणु (He₂):
- दो हीलियम परमाणु एक साथ आने पर एक बॉन्डिंग (σ1s) और एक एंटी-बॉन्डिंग (σ*1s) कक्षीय बनाते हैं। चूंकि बॉन्डिंग और एंटी-बॉन्डिंग कक्षीयों में इलेक्ट्रॉनों की संख्या बराबर होती है, इसलिए बॉन्ड ऑर्डर 0 होता है, और यह अणु अस्थिर होता है।

- ऑक्सीजन अणु (O₂):
- ऑक्सीजन अणु में π2p और π*2p कक्षीयें होती हैं। बॉन्ड ऑर्डर 2 होता है, जिससे यह अणु एक डबल बॉन्ड के साथ स्थिर होता है।

- नाइट्रोजन अणु (N₂):
- नाइट्रोजन अणु में σ2p कक्षीय में 6 इलेक्ट्रॉन होते हैं। बॉन्ड ऑर्डर 3 होता है, जो इसे एक ट्रिपल बॉन्ड के साथ अत्यधिक स्थिर बनाता है।
- कार्बन डाइऑक्साइड (CO₂):
- कार्बन डाइऑक्साइड में C और O के बीच σ और π कक्षीयों के संयोजन से डबल बॉन्ड बनते हैं, जो अणु को रैखिक (linear) संरचना देते हैं।
- बेन्जीन (C₆H₆):
- बेन्जीन में π इलेक्ट्रॉन आण्विक कक्षीय में डेलोकलाइज होते हैं, जो इसे एक स्थिर और समतल (planar) संरचना प्रदान करते हैं।
- कार्बन मोनोऑक्साइड (CO):
- CO अणु में बॉन्डिंग कक्षीय में इलेक्ट्रॉनिक वितरण से बॉन्ड ऑर्डर 3 होता है, जो इसे अत्यधिक स्थिर बनाता है।
- लिथियम अणु (Li₂):
- Li₂ अणु में बॉन्ड ऑर्डर 1 होता है, क्योंकि σ2s बॉन्डिंग कक्षीय में 2 इलेक्ट्रॉन होते हैं, और यह अणु भी स्थिर होता है।

- फ्लोरीन अणु (F₂):
- F₂ अणु में बॉन्ड ऑर्डर 1 होता है, क्योंकि σ2p कक्षीय में बॉन्डिंग और एंटी-बॉन्डिंग इलेक्ट्रॉनों की संख्या में एक का अंतर होता है।

- आमोनिया अणु (NH₃):
- NH₃ अणु में नाइट्रोजन के 2s और 2p कक्षीय हाइब्रिडाइज होकर स्प³ हाइब्रिड कक्षीय बनाते हैं, जिससे तीन सिग्मा (σ) बंधन बनते हैं।
ये उदाहरण आण्विक कक्षीय सिद्धांत के विभिन्न पहलुओं को स्पष्ट करते हैं और यह बताते हैं कि किस प्रकार इलेक्ट्रॉनिक कक्षीयों के संयोजन से अणुओं के बंधन और संरचना का निर्माण होता है।